Kolik jste obdrželi hlášení podezření na následně vyjmenované konkrétní nežádoucí účinky vakcín určených pro pravidelné, mimořádné a zvláštní očkování nebo vakcín proti nemoci covid-19 konkrétně v letech 2017, 2018, 2019, 2020 a v letošním roce? Žádáme o počty k těmto nežádoucím účinkům: úmrtí, anafylaxe nebo anafylaktická reakce, brachiální neuritida, encefalopatie nebo encefalitida, chronická artritida, trombocytopenická purpura, spalničky vyvolané vakcinačním kmenem.
Odpověď SÚKL:
Počty nahlášených konkrétních reakcí jsou uvedeny souhrnně pro všechny vakcíny.
Pro účely výpisu počtu nahlášených reakcí není možné vakcíny dělit dle členění očkování uvedeného v ustanovení § 2 vyhlášky č. 537/5006 Sb., o očkování proti infekčním nemocem, tj. na pravidelné, zvláštní, mimořádné aj. z důvodu, že tatáž vakcína může být použita v rámci více typů očkování. Informace o tom, v rámci jakého očkování byla vakcína použita, není při hlášení vyžadována, z pohledu hodnocení bezpečnosti jednotlivých vakcín nejde o významnou informaci.
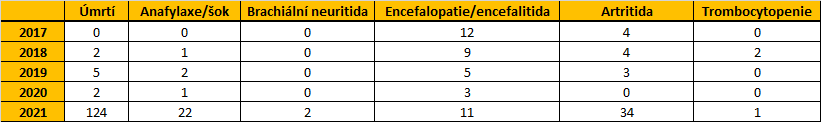
Požadované počty uvedených reakcí v letech 2017 – 2021 (do data 8. 11. 2021) jsou:
V roce 2017: nebylo hlášeno žádné podezření na nežádoucí účinek s následkem úmrtí (poznámka, dále uvedeno v bodě 6: úmrtí samo o sobě není nežádoucím účinkem – nežádoucí účinek je reakce, která může skončit úmrtím); bylo hlášeno 0 podezření na nežádoucí účinek charakteru anafylaxe, anafylaktická reakce; bylo hlášeno 0 podezření na nežádoucí účinek charakteru brachiální neuritida (radikulitida brachiální a neuralgická amyotrofie); bylo hlášeno 12 podezření na nežádoucí účinek charakteru encefalopatie, encefalitida – včetně cerebelitid; byla hlášena 4 podezření na nežádoucí účinek charakteru artritidy (artritididy bez rozlišení, není možné výpisem odlišit pouze chronické artritidy); bylo hlášeno 0 podezření na nežádoucí účinek charakteru trombocytopenická a trombotická trombocytopenická purpura.
V roce 2018: byla hlášena 2 podezření na nežádoucí účinek s následkem úmrtí (poznámka, dále uvedeno v odpovědi k bodu 6 žádosti: úmrtí samo o sobě není nežádoucím účinkem – nežádoucí účinek je reakce, která může skončit úmrtím); bylo hlášeno 1 podezření na nežádoucí účinek charakteru anafylaxe, anafylaktická reakce; bylo hlášeno 0 podezření na nežádoucí účinek charakteru brachiální neuritida (radikulitida brachiální a neuralgická amyotrofie); bylo hlášeno 9 podezření na nežádoucí účinek charakteru encefalopatie, encefalitida – včetně cerebelitid; byla hlášena 4 podezření na nežádoucí účinek charakteru artritidy (artritididy bez rozlišení, není možné výpisem odlišit pouze chronické artritidy); byla hlášena 2 podezření na nežádoucí účinek charakteru trombocytopenická a trombotická trombocytopenická purpura.
V roce 2019: bylo hlášeno 5 podezření na nežádoucí účinek s následkem úmrtí (poznámka, dále uvedeno v odpovědi k bodu 6 žádosti: úmrtí samo o sobě není nežádoucím účinkem – nežádoucí účinek je reakce, která může skončit úmrtím); byla hlášena 2 podezření na nežádoucí účinek charakteru anafylaxe, anafylaktická reakce; bylo hlášeno 0 podezření na nežádoucí účinek charakteru brachiální neuritida (radikulitida brachiální a neuralgická amyotrofie); bylo hlášeno 5 podezření na nežádoucí účinek charakteru encefalopatie, encefalitida – včetně cerebelitid; byla hlášena 3 podezření na nežádoucí účinek charakteru artritidy (artritididy bez rozlišení, není možné výpisem odlišit pouze chronické artritidy); bylo hlášeno 0 podezření na nežádoucí účinek charakteru trombocytopenická a trombotická trombocytopenická purpura.
V roce 2020: byla hlášena 2 podezření na nežádoucí účinek s následkem úmrtí (poznámka, dále uvedeno v odpovědi k bodu 6 žádosti: úmrtí samo o sobě není nežádoucím účinkem – nežádoucí účinek je reakce, která může skončit úmrtím); bylo hlášeno 1 podezření na nežádoucí účinek charakteru anafylaxe, anafylaktická reakce; bylo hlášeno 0 podezření na nežádoucí účinek charakteru brachiální neuritida (radikulitida brachiální a neuralgická amyotrofie); byla hlášena 3 podezření na nežádoucí účinek charakteru encefalopatie, encefalitida – včetně cerebelitid; bylo hlášeno 0 podezření na nežádoucí účinek charakteru artritidy (artritididy bez rozlišení, není možné výpisem odlišit pouze chronické artritidy); bylo hlášeno 0 podezření na nežádoucí účinek charakteru trombocytopenická a trombotická trombocytopenická purpura.
V roce 2021: bylo hlášeno 124 podezření na nežádoucí účinek s následkem úmrtí (poznámka, dále uvedeno v odpovědi k bodu 6 žádosti: úmrtí samo o sobě není nežádoucím účinkem – nežádoucí účinek je reakce, která může skončit úmrtím); bylo hlášeno 22 podezření na nežádoucí účinek charakteru anafylaxe, anafylaktická reakce; byla hlášena 2 podezření na nežádoucí účinek charakteru brachiální neuritida (radikulitida brachiální a neuralgická amyotrofie); bylo hlášeno 11 podezření na nežádoucí účinek charakteru encefalopatie, encefalitida – včetně cerebelitid; bylo hlášeno 34 podezření na nežádoucí účinek charakteru artritidy (artritididy bez rozlišení, není možné výpisem odlišit pouze chronické artritidy); bylo hlášeno 1 podezření na nežádoucí účinek charakteru trombocytopenická a trombotická trombocytopenická purpura.
Pozn. uvedená hlášení o podezření na nežádoucí účinek nevypovídají o tom, že daný nežádoucí účinek bylo v příčinné souvislosti s podanou vakcínou.
Kolik ze všech hlášení podezření na NÚ vakcíny proti covid-19 se týkalo dětí do 18 let věku a kolik z nich se týkalo těhotných žen?
Odpověď SÚKL:
Ze všech hlášení podezření na nežádoucí účinky vakcín proti Covid-19 se 117 hlášení týkalo dětí do 18 let včetně a 13 hlášení se týkalo těhotných žen (do data 8. 11. 2021).
Disponuje Váš ústav podklady o tom, že vakcíny proti covid-19, které jsou u nás povoleny, jsou bezpečné pro těhotné ženy? Prosíme o jejich poskytnutí.
Odpověď SÚKL:
Informace týkající se používání vakcín u těhotných žen jsou uvedeny v souhrnech údajů o přípravku pro jednotlivé vakcíny (platné k 8. 11. 2021):
Comirnaty:
Údaje o podávání vakcíny Comirnaty těhotným ženám jsou omezené. Studie na zvířatech nenaznačují přímé ani nepřímé škodlivé účinky na těhotenství, vývoj embrya/plodu, porod nebo postnatální vývoj. Podávání vakcíny Comirnaty v těhotenství se má zvážit pouze v případě, pokud možné přínosy převáží jakákoli potenciální rizika pro matku a plod.
Spikevax:
Údaje o podávání vakcíny Spikevax těhotným ženám jsou omezené. Studie reprodukční toxicity na zvířatech nenaznačují přímé ani nepřímé škodlivé účinky na těhotenství, vývoj embrya/plodu, porod nebo postnatální vývoj. Podávání vakcíny Spikevax v těhotenství má být zváženo pouze v případě, že možné přínosy převáží potenciální rizika pro matku a plod.
Vaxzevria:
K dispozici jsou omezené zkušenosti s použitím vakcíny Vaxzevria u těhotných žen. Studie na zvířatech nenaznačují přímé nebo nepřímé škodlivé účinky na těhotenství, vývoj embrya/plodu, porod nebo postnatální vývoj. Podání vakcíny Vaxzevria během těhotenství má být zváženo pouze v případě, že potenciální přínosy podání vakcíny převažují nad potenciálními riziky pro matku a plod.
Covid-19 Vaccine Janssen:
Zkušenosti s použitím vakcíny COVID-19 Vaccine Janssen u těhotných žen jsou omezené. Studie vakcíny COVID-19 Vaccine Janssen na zvířatech nenaznačují přímé ani nepřímé škodlivé účinky na březost, vývoj embrya/plodu, vrh nebo postnatální vývoj. Podání vakcíny COVID-19 Vaccine Janssen v těhotenství má být zváženo pouze v případě, že potenciální přínosy podání vakcíny převáží nad potenciálními riziky pro matku a plod.
Dále odkazujeme na odborné stanovisko České vakcinologické společnosti ČLS JEP:
https://koronavirus.mzcr.cz/wp-content/uploads/2021/06/Stanovisko-k-o%C4%8Dkov%C3%A1n%C3%ADproti-
onemocn%C4%9Bn%C3%AD-covid-19-u-t%C4%9Bhotn%C3%BDch-a-koj%C3%ADc%C3%ADch-
%C5%BEen.pdf
Jakou podhlášenost nežádoucích účinků vakcín určených pro povinné očkování v současné době odhadujete? A jakou odhadujete podhlášenost nežádoucích účinků vakcín proti covid-19?
Odpověď SÚKL:
V obou případech se jedná o dotaz na názor Ústavu, přičemž v souladu s ustanovením § 2 odst. 4 zákona o svobodném přístupu k informacím, které stanoví, že, cit.: „povinnost poskytovat informace se netýká dotazů na názory, budoucí rozhodnutí a vytváření nových informací“, nemá Ústav povinnost takové informace poskytovat, a proto je společně s tímto dopisem zároveň vydáno Rozhodnutí o odmítnutí části žádosti o poskytnutí informace sp. zn. sukls284010/2021, č.j. sukl312527/2021 ze dne 16. 11. 2021, které je Vám rovněž doručováno prostřednictvím datové schránky.
Prosíme o seznam počtu hlášení podezření NÚ úmrtí po vakcínách proti covid-19 po jednotlivých měsících.
Odpověď SÚKL:
Ústav při poskytování informací z farmakovigilančního systému přihlíží v souladu s ustanovením § 99 odst. 2 písm. f) zákona o léčivech ke kvalifikaci žadatele a účelu využití informace. S ohledem na tuto skutečnost poskytuje Ústav informace v rozsahu poskytnutém tímto vyjádřením. Informace o počtu hlášených úmrtí v jednotlivých měsících Ústav považuje za irelevantní pro uvedený účel použití této informace. Úmrtí samo o sobě není nežádoucím účinkem – nežádoucí účinek je reakce, která může skončit úmrtím. Pokud na základě relativně zvýšeného počtu určitých reakcí v souhrnných datech z celého světa v EMA databázi EudraVigilance vznikne podezření na možný nový nežádoucí účinek, je zahájeno podrobné hodnocení všech dostupných údajů za celou dobu používání dané vakcíny. Hlášena jsou pouhá podezření na nežádoucí účinek, nikoli skutečně prokázané nežádoucí účinky. Teprve podrobné hodnocení může ověřit, zda hlášená podezřelá reakce pravděpodobně je či není nežádoucím účinkem dané vakcíny. Při takovém hodnocení ale nemá žádný význam dělit počty hlášení na jednotlivé měsíce. Navíc datum hlášení často neodpovídá datu nástupu reakce (v praxi často dochází ke zpětnému hlášení nežádoucích účinků).
Jak v současné době motivujete zdravotníky k hlášení nežádoucích účinků vakcín?
Odpověď SÚKL:
Informace o hlášení podezření na nežádoucí účinky léčiv je uvedena na webových stránkách Ústavu https://www.sukl.cz/nahlasit-nezadouci-ucinek. Vzhledem ke zvýšené potřebě pečlivého sběru hlášení podezření na nežádoucí účinky vakcín proti Covid-19 byl nově od konce r. 2020 zdůrazněn odkaz na informace o hlášení – tento odkaz je umístěn na hlavní stránce webu Ústavu a je barevně zdůrazněn. Informace o hlášení je uvedena v Souhrnu údajů o přípravku (SmPC) a Příbalové informaci (PIL) každého léčivého přípravku. Při zjištění nového závažného nežádoucího účinku je zdravotníkům rozesílán dopis s novými informacemi – v každém takovém dopise je připomínána povinnost hlásit podezření na nežádoucí účinky.
K vakcínám proti Covid-19 bylo letos rozesláno už 9 dopisů. V neposlední řadě v minulém týdnu v České republice proběhla kampaň vedená Ústavem mající za cíl zvýšení počtu hlášení nežádoucích účinků. Tato kampaň byla součástí mezinárodní akce MedSafetyWeek: https://www.sukl.cz/sukl/pomozte-zlepsit-ockovanipro-vsechny-staci-nahlasit






