Přeložený článek COVID-19 vaccine efficacy and effectiveness—the elephant (not) in the room z odborného časopisu Lancet. Za pomoc s překladem děkujeme panu doktorovi V. Čížkovi.
Vydáno 20. dubna 2021
Piero Olliaro * Els Torreele * Michel Vaillant
Momentálně probíhají různé fáze klinického vývoje přibližně 96 vakcín proti nemoci covid-19. V současnosti máme k dispozici předběžné výsledky čtyř studií publikovaných ve vědeckých časopisech (k vakcínám Pfizer-BioNTech BNT162b2 mRNA, Moderna-US NIH mRNA-1273, AstraZeneca-Oxford ChAdOx1 nCov-19 a Gamaleya GamCovidVac [Sputnik V]) a tří studií z informativních dokumentů amerického Úřadu pro kontrolu potravin a léčiv (FDA) (k vakcínám Pfizer-BioNTech, Moderna-NIH a Johnson&Johnson [J&J] Ad26.COV2.S). Výňatky z těchto výsledků byly navíc zveřejňovány prostřednictvím tiskových zpráv a široce rozebírány v médiích, někdy i zavádějícím způsobem. Přestože se pozornost soustředila na účinnost vakcín a srovnání snížení počtu symptomatických případů, plné porozumění účinnosti a efektivnosti vakcín je méně přímočaré, než se může zdát. V závislosti na způsobu vyjádření velikosti účinku může vyvstat zcela odlišný obrázek.
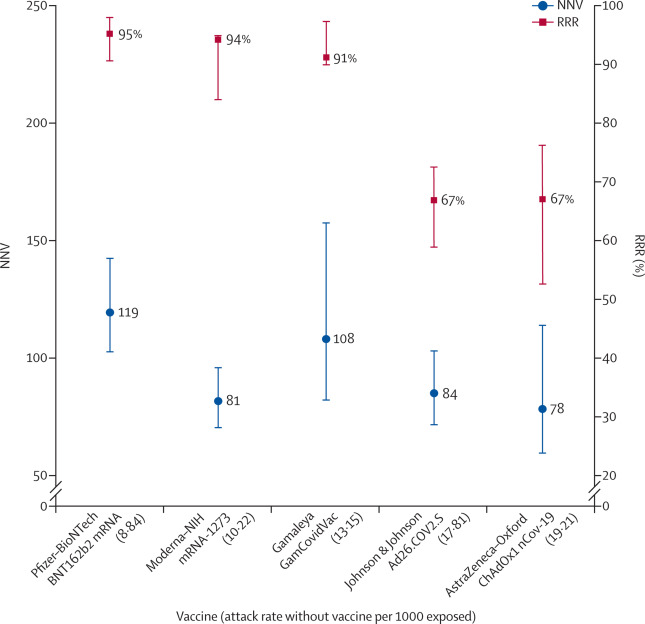
Účinnost vakcín se obecně udává jako snížení relativního rizika (RRR). Využívá se relativního rizika (RR), tj. poměru míry nákazy s vakcínou a bez ní, což se vyjadřuje jako 1-RR. Z udávané účinnosti vyplývá toto pořadí vakcín: 95 % Pfizer-BioNTech, 94 % Moderna-NIH, 90 % Gamaleya, 67 % J&J a pro AstraZeneca-Oxford. Na RRR by se však mělo nahlížet skrze riziko toho, že se člověk nakazí a onemocní covidem-19, které se mění v populaci i v průběhu času. Přestože RRR uvažuje pouze účastníky, jimž očkování přináší prospěch, snížení absolutního rizika (ARR), což je rozdíl mezi mírou nákazy s vakcínou a bez ní, uvažuje celou populaci. ARR se obvykle přehlíží, jelikož přináší mnohem méně působivou velikost účinku než RRR: 1,3 % u vakcíny AstraZeneca-Oxford, 1,2 % u Moderna-NIH, 1,2 % u J&J, 0,93 % u Gamaleya a 0,84 % u Pfizer-BioNTech.
ARR se také používá k odvození odhadu efektivnosti vakcín, což je počet osob, které je nutné očkovat (NNV), aby se zamezilo jednomu dalšímu případu covid-19, jako 1/ARR. NNV přináší odlišný pohled: 76 u vakcíny Moderna-NIH, 78 u AstraZeneca-Oxford, 80 u Gamaleya, 84 u J&J a 117 u Pfizer-BioNTech. Vysvětlení spočívá v kombinaci účinnosti vakcíny a odlišných rizik prostředí nemoci covid-19 ve studiích: 0,9 % u Pfizer-BioNTech, 1 % u Gamaleya, 1,4 % u Moderna-NIH, 1,8 % u J&J a 1,9 u AstraZeneca-Oxford.
ARR (a NVV) jsou citlivé k riziku prostředí (čím vyšší riziko, tím vyšší efektivnost), jak dokládají analýzy vakcíny J&J centrálně potvrzených případů v porovnání se všemi případy: mění se čitatel i jmenovatel, RRR se nemění (66–67 %), třetinový nárůst míry nákazy v neočkované skupině (z 1,8 % na 2,4 %) však vysvětluje čtvrtinový pokles v NNV (z 84 na 64).
Ze způsobů, jimiž se provádějí studie a prezentují výsledky, lze získat mnoho poznatků. Pokud se použije pouze RRR a vynechá ARR, dostáváme zkreslený pohled, který ovlivňuje interpretaci účinnosti vakcíny. Při oznamování účinnosti vakcíny, zejména pro rozhodnutí v rámci zdravotnictví jako třeba výběr typu vakcíny, která se zakoupí a bude očkovat, je důležité mít k dispozici úplný obrázek toho, co předložená data skutečně ukazují, a také zajistit, aby srovnání byla založena na kombinovaných důkazech, které dávají do kontextu výsledky testů vakcín, aby se nesledovala pouze jedno souhrnné opatření. Taková rozhodnutí by měla vycházet z detailního pochopení výsledků studií, přičemž je nutný přístup k úplným souborům dat a nezávislým přezkumům a analýzám.
Porovnání vakcín na základě momentálně dostupných (předběžných) zkušebních dat bohužel ještě více ztěžují nesourodé protokoly o studiích, včetně primárních endpointů (jako třeba co se považuje za případ onemocnění covidem-19 a kdy se to vyhodnotí), typy placeba, populace účastnící se studií, rizika prostředí nemoci covid-19 během studie, doba trvání expozice a různé definice populace pro analýzy v rámci studií i mezi nimi, stejně jako definice endpointů a statistických metod pro účinnost. Co je však důležité, zůstává nám nezodpovězená otázka, zda vakcína s danou účinností v populaci, na která se zúčastnila studie, bude mít stejnou účinnost v jiné populaci s odlišnými úrovněmi rizika prostředí nemoci covid-19. Nejedná se o triviální otázku; intenzita přenosu se v jednotlivých zemích liší, jelikož je ovlivněná takovými faktory jako zdravotnické intervence a varianty viru. Jedinou oznámenou indikací efektivnosti vakcíny je hromadné očkování v Izraeli vakcínou Pfizer-BioNTech. Přestože koncepce a metodika se radikálně liší od randomizované klinické studie, Dagan a kolegové uvádějí hodnotu RRR 94 %, což je v zásadě stejné jako RRR ve třetí fázi klinické studie (95 %), avšak s ARR 0,46 %, což dává hodnotu NNV 217 (když ARR bylo 0,84 % a NNV 119 ve třetí fázi klinické studie). Ve skutečném prostředí to znamená, že pro zamezení jednoho dalšího případu onemocnění covid-19 bude možná nutné očkovat 1,8x více subjektů, než předpověděla odpovídající klinická studie.
Nekoordinované třetí fáze klinických studií neuspokojují požadavky zdravotnictví; studie na platformě určené k řešení otázek týkajících se veřejného zdraví se společným protokolem umožní přijímat rozhodnutí na základě společných kritérií a jednotného posuzování. Tyto úvahy o účinnosti a efektivnosti vycházejí ze studií měřících prevenci mírného až středního průběhu onemocnění covid-19; nebyly koncipované k vyvození závěrů ohledně prevence hospitalizace, vážného onemocnění či smrti nebo prevence potenciálu nákazy a přenosu. Při posuzování vhodnosti vakcín se musí vzít v úvahu všechny ukazatele a zahrnout bezpečnost, použitelnost, dostupnost a náklady.
Reference
- Zimmer C, Corum J, Wee S-L
Covid-19 Vaccine Tracker.
https://www.nytimes.com/interactive/2020/science/coronavirus-vaccine-tracker.html
Date accessed: March 10, 2021
View in Article
- Zimmer C, Corum J, Wee S-L
- Polack FP, Thomas SJ, Kitchin N, et al.
Safety and efficacy of the BNT162b2 mRNA COVID-19 Vaccine.
N Engl J Med. 2020; 383: 2603-2615
View in Article
- Polack FP, Thomas SJ, Kitchin N, et al.
- Baden LR, El Sahly HM, Essink B, et al.
Efficacy and safety of the mRNA-1273 SARS-CoV-2 Vaccine.
N Engl J Med. 2021; 384: 403-416
View in Article
- Baden LR, El Sahly HM, Essink B, et al.
- Voysey M, Clemens SAC, Madhi SA, et al.
Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK.
Lancet. 2021; 397: 99-111
View in Article
- Voysey M, Clemens SAC, Madhi SA, et al.
- Logunov DY, Dolzhikova IV, Shcheblyakov DV, et al.
Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia.
Lancet. 2021; 397: 671-681
View in Article
- Logunov DY, Dolzhikova IV, Shcheblyakov DV, et al.
- US Food and Drug Administration
Vaccines and Related Biological Products Advisory Committee meeting: FDA briefing document.
https://www.fda.gov/advisory-committees/advisory-committee-calendar/vaccines-and-related-biological-products-advisory-committee-december-10-2020-meeting-announcement
Date: Dec 10, 2020
Date accessed: March 10, 2021
View in Article
- US Food and Drug Administration
- US Food and Drug Administration
Vaccines and Related Biological Products Advisory Committee meeting: FDA briefing document.
https://www.fda.gov/advisory-committees/advisory-committee-calendar/vaccines-and-related-biological-products-advisory-committee-december-17-2020-meeting-announcement
Date: Dec 17, 2020
Date accessed: March 10, 2021
View in Article
- US Food and Drug Administration
- US Food and Drug Administration
Vaccines and Related Biological Products Advisory Committee meeting: FDA briefing document.
https://www.fda.gov/advisory-committees/advisory-committee-calendar/vaccines-and-related-biological-products-advisory-committee-february-26-2021-meeting-announcement
Date: Feb 26, 2021
Date accessed: March 10, 2021
View in Article
- US Food and Drug Administration
- Olliaro P
What does 95% COVID-19 vaccine efficacy really mean?.
Lancet Infect Dis. 2021; (published online Feb 17.)
https://doi.org/10.1016/S1473-3099(21)00075-XView in Article
- Olliaro P
- Brown RB
Outcome reporting bias in COVID-19 mRNA vaccine clinical trials.
Medicina (Kaunas). 2021; 57: 199
View in Article
- Brown RB
- Dagan N, Barda N, Kepten E, et al.
BNT162b2 mRNA COVID-19 vaccine in a nationwide mass vaccination setting.
N Engl J Med. 2021; (published online Feb 24.)
https://doi.org/10.1056/NEJMoa2101765
- Dagan N, Barda N, Kepten E, et al.






